さらに沢山の疫学的研究があり、その内あるものは人種による罹患性の違いを除くために、海外移住者と移住しなかった人たちの健康記録を比較した(140)。ある調査ではカリフォルニアに移住して少なくとも部分的に食事がアメリカ的になった日本人の虚血性心疾患(IHD)は、日本の対応する住民の非常に低い罹患率のほぼ3倍であった(141)。
だれもアメリカ人に日本食を摂るように説得することはできないので、 ”地中海食事” は実践できる理想になり始めた。しかし、 ”地中海食事” は1950年および1960年代にどのような構成だったろうか?かなり大きな違いがあった。ユーゴスラビアの一つの研究地域では1日96gの魚を食べ、他の研究地域では皆無であったが、IHD死亡率は似ていた。ギリシャ人コミュニティでは1日35gの肉しか食べず、一つのユーゴスラビア人コミュニティでは1日200gであったが、IHD死亡率はやはり似ていた。ギリシャ人およびイタリア人のコミュニティは大量の果物と野菜を消費していたが、ユーゴスラビア人はオランダ人やアメリカ人のグループより多くはなかった(142,143)。
ジェイムズ(Philip James)と共同研究者が提出した、地中海食事は "保護作用がある(安全である)のか、または毒性が無いのか” の疑問が解決されないままである(144)。他の国のもっと豊かな食事は、水素添加された油からのトランス-脂肪酸の存在によって悪化したのか、葉物野菜からの抗酸化物の不足によるのであろうか?1985年にこれらの疑問は将来の研究に任せられていた。
リポタンパク質.
コレステロールはタンパク質と結合して血液中で運ばれる。1950年にバークレー・グループは血清リポタンパク質を分離する方法を開発し、低密度-またはβ-リポタンパク質が高いと動脈硬化の危険が高くなることを示唆した。1959年にオルソン(Robert Olson)はこの分画が重要である事実を提供した。1977年にNIHの膨大なフラミンガム(Framingham)研究は、リポタンパク質の調査が行われていた79人の冠状動脈死の解析によって、最高の危険はHDLすなわちα-リポタンパク質のコレステロールが低いヒトであることを示した。44 mg/100 mLまたはそれ以下なら、105/1,000であり、それより多い場合、 48/1,000 であることを示した(147)。言い換えると、HDLは良い形のコレステロールであった。しかし、この形のコレステロールは全体の一部に過ぎないので、全ステロールを測定した以前の研究は今でも価値がある。
学術研究会議(NRC)の、ガンに対する食事と栄養の影響を研究する委員会は1982年に、”食事のすべての成分を研究した限りで、疫学的および実験的な事実を総合すると、脂肪摂取とガン....とくに乳がん、直腸がん....の間の原因関係が最も強く示唆される。コレステロールとガン危険率の関係はあまりも制限が多いので、結論を出すことが出来ない” と報告した(148)。
多価不飽和脂肪酸.
以前のセクションで述べたように多価不飽和脂肪酸(PUFA)は、 C-20 に鎖を延ばし、種々のホルモン活性を持っているプロスタグランジンを作ることが示された。とくにプロスタグランジンのあるものは血小板の凝固を促進するが、あるものは主として阻害する(149)。このことは多価不飽和脂肪酸を多く消費する人たちで動脈壁のプラーク(アテローム斑)生成の少ないことを説明できた。
また、多価不飽和脂肪酸が血圧降下作用を示すのは、プロスタグランジン類合成のバランスが好適な状態のためとまず考えられた(150)。しかし、プロスタグランジン類をラットに注射すると、短時間の効果しか見られなかった。これは多分プロスタグランジンは不安定であり、作用する組織で合成されなければならなかったからであろう(120)。
植物の不飽和脂肪が動物の飽和脂肪に比べて、人間でもラットでも、血清コレステロールレベルを下げることが最初に見つかったときに、これまで知られている必須脂肪酸(EFA)すなわちリノール酸および多分リノレン酸が多いためと考えられた。魚油は不飽和度は高いものの上記の2種の脂肪酸は少ないので、血清コレステロールを低下させるとは思っていなかった。しかし実際は、ヒトに対してもラットに対しても、魚油は植物油と同じまたはそれ以上に有効であった(151-153)。
続いて魚油は血清脂質を下げるだけでなく、虚血性心疾患予防に有効なことが示唆された。魚油の多価不飽和脂肪酸 C20:5(n-3) エイコサペンタエン酸からのプロスタグランジンは、植物のリノレン酸誘導体である C20:4(n-6) 由来のものより、血小板凝固を抑える効果の極めて大きいことが示された(154)。魚油の効果は続いての研究で示されたが、出血時間がある程度長くなることが観察された(155)。
この期間の最後にオランダから、魚を毎日ゼロから45gまで摂取する800人以上の中年男性の追跡結果が報告された。20年の研究で78人が虚血性心疾患(IHD)で死亡し、"高度消費者" の危険率は消費しない人たちの42%に過ぎず、消費が増えるほど危険率の低下傾向が見られた(156)。
食物繊維.
アフリカの異なる場所で長年の経験をもった2人の医師がそれぞれ、工業国ではふつうである非感染性疾患が、その地ではあまりに少ないことに印象を受けた。1969年にバーキット(Denis Burkitt)は35~64歳の男性で結腸と直腸のガンが、コネチカットでは東アフリカの約10倍であり、プエルトリコや多くのアジアの国はその中間であることを、指摘した。彼は ”腸のガンその他の非感染性の病気は調べたところ、残渣が多い食事の国では稀で、残渣が少ない食事の国では普通である。異常な腸内細菌叢の作用で作られた発ガン物質が腸粘膜と長いあいだ接触しているのが、これらの病気の発現率が多い理由であろう....” (157)。1972年にトロウェル(Hugh Trowell)は発展途上国で人たちを虚血性心疾患(IHD)から守っているのは食物性繊維が多いことであろうと示唆した(158)。これらやその他の論文に続いて食事における繊維の役割に興味が持たれるようになったが、食物繊維にはいろいろな種類があって定義の困難なことが理解された。それに加えて果物や野菜を大量に食べることによって繊維を多く摂取している人々は、タンパク質や脂肪の摂取は少ない傾向があった。ここで3つの論文を引用しよう。ミネソタ大学のキーズらは、脂肪を一定にして、穀物やショ糖の代わりに大量の果物と野菜を与えることによって、血漿コレステロールは10%低下したが、これは必ずしも繊維が増えたためとは言えなかった(159)。オーストラリアの研究では、15g/dの柑橘類ペクチン(いわゆる”水溶性繊維")は緩下剤の作用は無いが血漿コレステロールを13%低下させたが、セルロースは緩下剤の効果しか無かった(160)。大腸で繊維が発酵すると短鎖脂肪酸(SCFA)量を増加させ、これが抗ガン作用を持つ可能性が示唆された(161)。
この期間に、西側諸国風の食事を摂っている共同体では種々の非感染性の成人病の多い事実が強く認められた(162,163)。西側諸国風の共同体でも菜食主義者は虚血性心疾患の危険性が低いことが観察されたが、これが果物と野菜(したがって繊維)の摂取が多いからか、動物性脂肪の摂取が少ないからかは明らかでない(164)。食物繊維の緩下剤作用は評価され続けているが、繊維の少ないことが西側諸国風の食事を摂っている住民で大腸ガンが多いことに直接の原因となる特異的な因子であるか否かは証明されていない(148,165)。また南アフリカで、町(訳注:南アフリカでは黒人居住地区)に移って繊維が少ない西側諸国風の食事を摂るようになったアフリカ人で、直腸ガンのやはり少ないことが確かめられた(166)。 |
| エピローグ |
ある人々にとって栄養科学は実質的には1945年までに完成したように見えたが、40年後になってもそうではなかった。
人々が栄養学的な助言を入れるようになったとともに、煙草を吸わなくなったことや良い薬品が手に入るようになったので、裕福な国々では虚血性心疾患が減ってきている。しかし、肥満およびそれに伴う糖尿病の問題はいまだに増加していて、栄養科学は運動をしていない人たちには容易な解答を与えることができないでいる。1985年までに技術は進歩したが、人間機械は同じである。一部の人々はこれまでの労働-休息サイクルを逆にしている。すなわち、仕事(および旅行)を座って行い、休息をトレッドミル上でとっている。
200年にわたる先輩たちの努力と素晴らしい成果を敬意をもって振り返ることができる。それとともに特定の個人や住民の統計的平均の人々についてしなければならないことが残っている。食品中にあって病気に抵抗する役割を持っているような栄養素ではない化学物質についての研究は、ほんの始まったばかりである。 |
| LITERATURE CITED |
1. Carpenter, K. J. (2003) A short history of nutritional science: Part 4 (1945ー1985). J. Nutr. 133:638-645.
2. Carpenter, K. J. (2003) A short history of nutritional science: Part 2 (1885–1912). J. Nutr. 133:975-984.
3. Carpenter, K. J. (2003) A short history of nutritional science: Part 3 (1912–1944). J. Nutr. 133:3023-3032.
4. Stokstad, E.L.R. (1979) Early work with folic acid. Fed. Proc. 38:2696-2698.
5. Hutchings, B. L. & Mowat, J. H. (1948) Chemistry and biological action of pteroylglutamic acid and related compounds. Vit. Horm. 6:1-53.
6. Wagley, P. F. (1948) Neurological disturbances with folic acid therapy. New Engl. J. Med. 238:11-15.
7. Stokstad, E.L.R. & Jukes, T. H. (1987) Sulfonamides and folic acid antagonists: a historical review. J. Nutr. 117:1335-1341.
8. Emanuel, I. & Sever, L. E. (1973) Questions concerning the possible association of potatoes and neural-tube defects, and an alternative hypothesis relating to maternal growth and development. Teratology 8:325-332.
9. Hibberd, E. D. & Smithells, R. W. (1965) Folic acid metabolism and human embryopathy. Lancet i:1254.
10. Seller, M. J. & Nevin, N. C. (1984) Preconceptional vitamin supplementation and the prevention of neural tube defects in south-east England and Northern Ireland. J. Med. Genetics. 21:325-330.
11. Castle, W. B. & Townsend, W. C. (1929) Observations on the etiologic relationship of achylia gastrica to pernicious anemia. II. Am. J. Med. Sci. 178:762-777.
12. Rickes, E. L., Brink, N. G., Koniuszy, F. R., Wood, T. R. & Folkers, K. (1948) Crystalline vitamin B12. Science 107:396-397.
13. Fantes, K. H., Page, J. E., Parker, L.F.J. & Lester Smith, E. (1949) Crystalline anti-pernicious anaemia factor from liver. Proc. Roy. Soc. B. 136:592-613.
14. Lester Smith, E. (1965) Vitamin B12 3rd ed. 1965:14-21 Methuen London, UK.
15. Beck, W. S. (1982) Biological and medical aspects of vitamin B12. Dunlop, D. eds. B12 vol 2:1-30 Wiley New York, NY.
16. Lester Smith, E. (1965) :3-9 See cit. no. 14.
17. Cuthbertson, W.F.J. & Thornton, D. M. (1952) The assay of vitamin B12. 7. Br. J. Nutr. 6:170-175.
18. Morgan, T. B., Gregory, M. E., Kon, S. K. & Porter, J.W.G. (1961) Coprophagy and vitamin B12 in the rat. Proc. Nutr. Soc. 20:ix-x.
19. Dyke, W.J.C., Hind, H. G., Riding, D. & Shaw, G. E. (1950) Bacterial synthesis of vitamin B12 in the alimentary tract. Lancet i:486-488.
20. Stillions, M. C., Teeter, S. M. & Nelson, W. E. (1971) Utilization of dietary vitamin B12 and cobalt by mature horses. J. Anim. Sci. 32:252-255.
21. Wokes, F., Badenoch, J. & Sinclair, H. M. (1955) Human dietary deficiency of vitamin B12. Am. J. Clin. Nutr. 3:375-382.
22. Droop, W. R. (1957) Vitamin B12 in marine ecology. Nature 180:1041-1042.
23. Herbert, V. & Zalusky, R. (1962) Interrelations of vitamin B12 and folic acid metabolism: folic acid clearance studies. J. Clin. Invest. 41:1263-1275.
24. Herbert, V. & Das, K. C. (1976) The role of vitamin B12 and folic acid in hemato- and other cell-poiesis. Vit. Horm. 34:1-30.
25. McCully, K. S. (1969) Vascular pathology of homocysteinemia: implications for the pathogenesis of arteriosclerosis. Am. J. Path. 56:111-128.
26. Aykroyd, W. R. & Swaminathan, M. (1940) The nicotinic acid content of cereals and pellagra. Indian J. Med. Res. 27:667-677 [Reprinted in Carpenter, 1981, cit. no. 27, pp. 228–238].
27. Carpenter, K. J. eds. Pellagra 1981 Hutchinson Ross Stroudsburg, PA.
28. Krehl, W. A., Teply, L. J., Sarma, P. S. & Elvehjem, C. A. (1945) Growth-retarding effect of corn in nicotinic acid-low rations and its counteraction by tryptophane. Science 101:489-490.
29. Goldsmith, G. A., Miller, O. N. & Unglaub, W. G. (1961) Efficiency of tryptophan as a niacin precursor in man. J. Nutr. 73:172-176.
30. MacDonald, M. L., Rogers, Q. R. & Morris, J. G. (1984) Nutrition of the domestic cat, a mammalian carnivore. Ann. Rev. Nutr. 4:451-462.
31. Nishizuka, Y. & Hayaishi, O. (1963) Enzymic synthesis of niacin nucleotides from 3-hydroxyanthranilic acid in mammalian liver. J. Biol. Chem. 238:PC483-PC484.
32. Horwitt, M. K., Harvey, C. C., Rothwell, W. S., Curler, H.J.L. & Haffron, D. (1956) Tryptophan-niacin relationships in man: studies with diets deficient in riboflavin and niacin. J. Nutr. 60(Suppl. 1):1-43.
33. Kodicek, E, Braude, R., Kon, S. K. & Mitchell, K. G. (1956) The effect of alkaline hydrolysis of maize on the availability of its nicotinic acid to the pig. Br. J. Nutr. 10:51-67.
34. Carpenter, K. J. (1981) Effects of different methods of processing maize on its pellagragenic activity. Fed. Proc. 40:1531-1535.
35. Carter, E.G.A. & Carpenter, K. J. (1982) The available niacin values of foods for rats and their relation to analytical values. J. Nutr. 112:2091-2103.
36. Daft, F. S., Sebrell, W. H. & Lillie, R. D. (1942) Prevention by cystine or methionine of hemorrhage and necrosis of the liver in rats. Proc. Soc. Exp. Biol. Med. 50:1-5.
37. Glynn, L. E. & Himsworth, H. P. (1944) Massive acute necrosis of the liver: its significance and experimental production. J. Path. Bact. 56:297-305.
38. Schwarz, K. (1944) Tocopherol als Leberschutzstoff. Z. Physiol. Chem. 281:109-116.
39. Schwarz, K. (1951) Production of dietary necrotic liver degeneration using American torula yeast. Proc. Soc. Exp. Biol. Med. 77:818-823.
40. Schwarz, K. (1952) Casein and Factor 3 in dietary necrotic liver degeneration: concentration of Factor 3 from casein. Proc. Soc. Exp. Biol. Med. 80:319-323.
41. Naftalin, J. M. (1954) The influence of diet, environment and other factors on experimental liver necrosis in the rat. Proc. Nutr. Soc. 13:120-125.
42. Schwarz, K. & Foltz, C. M. (1957) Selenium as an integral part of Factor 3 against dietary necrotic liver degeneration. J. Am. Chem. Soc. 79:3292-3293.
43. Patterson, E. L., Milstrey, R. & Stokstad, E.L.R. (1957) Effect of selenium in preventing exudative diathesis in chicks. Proc. Soc. Exp. Biol. Med. 95:617-620.
44. Franke, K. W. & Van Potter, R. (1935) A new toxicant occurring naturally in certain samples of plant foodstuffs. IX. Toxic effects of orally ingested selenium. J. Nutr. 10:213-231.
45. Hartley, W. J. & Grant, A. B. (1961) A review of selenium responsive diseases of New Zealand livestock. Fed. Proc. 20:679-688.
46. Muth, O. H. (1963) White muscle disease, a selenium-responsive myopathy. J. Am. Vet. Med. Assoc. 142:272-277.
47. Oksanen, H. E. (1967) Selenium deficiency: clinical aspects and physiological responses in farm animals. Muth, O. H. eds. Selenium in Biomedicine 1967:215-229 Avi Westport, CT.
48. Andrews, E. D., Hartley, W. J. & Grant, A. B. (1968) Selenium-responsive diseases in New Zealand. New Zealand Vet. J. 16:3-17.
49. Rotruck, J. T., Pope, A. L., Ganther, H. E., Swanson, A. B., Hafeman, D. G. & Hoekstra, W. G. (1973) Selenium: biochemical role as a component of glutathione peroxidase. Science 179:588-590.
50. Ahrens, R. A. (1997) Glutathione peroxidase: a role for selenium (Rotruck 1972). J. Nutr. 127:1052S-1053S.
51. Cantor, A. H., Scott, M. L. & Noguchi, T. (1975) Biological availability of selenium in feedstuffs and selenium compounds for the prevention of exudative diathesis in chicks. J. Nutr. 105:96-105.
52. Robinson, M. F. & Thomson, C. D. (1983) The role of selenium in the diet. Nutr. Abstr. Rev. Ser. A. 53:1-26.
53. Combs, G. F., Jr Levander, O. A. Spallholz, J. E. Oldfield, J. E. eds. Selenium in Biology and Medicine 2 vol. Avi New York.
54. Schwarz, K. & Mertz, W. (1957) A glucose tolerance factor and its differentiation from Factor 3. Arch. Biochem. Biophys. 72:515-518.
55. Mertz, W. (1967) Biological role of chromium. Fed. Proc. 26:186-193.
56. Tucker, H. F. & Salmon, W. D. (1955) Parakeratosis or zinc deficiency in the pig. Proc. Soc. Exp. Biol. Med. 88:613-616.
57. Luecke, R. W., Hoefer, J. A., Brammell, W. S. & Schmidt, D. A. (1957) Calcium and zinc in parakeratosis of swine. J. Anim. Sci. 16:3-11.
58. O’Dell, B. L. (1969) Effect of dietary components upon zinc availability. Am. J. Clin. Nutr. 22:1315-1322.
59. Prasad, A. S., Miale, A., Farid, Z., Sandstead, H. H. & Schulert, A. (1963) Zinc metabolism in patients with the syndrome of iron deficiency anemia, hepatosplenomegaly, dwarfism, and hypogonadism. J. Lab. Clin. Med. 61:537-549.
60. Sandstead, H. H., Prasad, A. S., Schulert, A. R., Farid, Z., Miale, A., Bassilly, S. & Darby, W. J. (1967) Human zinc deficiency, endocrine manifestations and response to treatment. Am. J. Clin. Nutr. 20:422-442.
61. Ronaghy, H. A., Reinhold, J. G., Mahloudji, M., Ghavami, P., Spivey Fox, M. R. & Halsted, J. A. (1974) Zinc supplementation of malnourished schoolboys in Iran: increased growth and other effects. Am. J. Clin. Nutr. 27:112-121.
62. Reinhold, J. G., Nasr, K., Lahimgarzadeh, A. & Hedayati, H. (1973) Effects of purified phytate and phytate-rich bread upon metabolism of zinc, calcium, phosphorus and nitrogen in man. Lancet i:283-288.
63. Ccedil;avdar, A. O., Arcaso, A., Cin, S. & Gümüs, H. (1980) Zinc deficiency in geophagia in Turkish children and response to treatment with zinc sulphate. Haematologica 65:404-408.
64. Solomons, N. W. (1982) Biological availability of zinc in humans. Am. J. Clin. Nutr. 35:1048-1075.
65. Mills, C. F. (1985) Dietary interactions involving the trace elements. Ann. Rev. Nutr. 5:173-193.
66. Starcher, B., Hill, C. H. & Matrone, G. (1964) Importance of dietary copper in the formation of aortic elastin. J. Nutr. 82:318-322.
67. Klevay, L. M. (1980) Interactions of copper and zinc in cardiovascular disease. Ann. N.Y. Acad. Sci. 355:140-151.
68. Rose, W. C., Oesterling, M. J. & Womack, M. (1948) Comparative growth on diets containing ten and nineteen amino acids, with further observations upon the role of glutamic and aspartic acid. J. Biol. Chem. 176:753-762.
69. Rose, W. C. (1949) Amino acid requirements of man. Fed. Proc. 8:546-552.
70. Rose, W. C. & Wixom, R. L. (1955) Amino acid requirements of man: 16. The role of nitrogen intake. J. Biol. Chem. 217:997-1004.
71. Rose, W. C. (1957) The amino acid requirements of adult man. Nutr. Abstr. Rev. 27:631-647.
72. Calloway, D. H. & Spector, H. (1954) Nitrogen balance as related to caloric and protein intake in active young men. Am. J. Clin. Nutr. 2:405-412.
73. Widdowson, E. M. & McCance, R. A. (1954) Studies on the nutritive value of bread and on the effect of variations in the extraction rate of flour on the growth of undernourished children 1954 Medical Research Council Special Report Ser. no. 287, Her Majesty’s Stationery Office London, UK.
74. Carpenter, K. J. (1975) The nutritive value of wheat proteins. Spicer, A. eds. Bread: Social, Nutritional and Agricultural Aspects of Wheaten Bread 1975:93-114 Applied Science Publishers London, UK.
75. Young, V. R., Rand, W. M. & Scrimshaw, N. S. (1977) Measuring protein quality in humans: a review and proposed method. Cereal Chem 54:929-948.
76. Young, V. R., Meredith, C., Hoerr, R., Bier, D. M. & Matthews, D. E. (1985) Garrow, J. S. Halliday, D. eds. In Substrate and Energy Metabolism 1985:119-134 John Libbey London, UK.
77. Millward, D. J. (1985) Human protein requirements: the physiological significance of changes in the rate of whole-body protein turnover. Garrow, J. S. Halliday, D. eds. Substrate and Energy Metabolism 1985:135-144 John Libbey London, UK.
78. Grau, C. R. (1948) Effect of protein level on the lysine requirement of the chick. J. Nutr. 36:99-108.
79. Harper, A. E., Becker, R. V. & Stuck, W. P. (1966) Some effects of excessive intakes of indispensable amino acids. Proc. Soc. Exp. Biol. Med. 121:695-699.
80. Food, Nutrition Board (1959) Evaluation of Protein Nutrition. Publ. No. 711, pp. 27–33. National Research Council, Washington, DC.
81. Brosnan, J. T. & Brosnan, M. E. (1982) Dietary protein, metabolic acidosis and calcium balance. Adv. Nutr. Res. 4:77-105.
82. Hegsted, D. M., Tsonghas, A. G., Abbott, D. B. & Stare, F. J. (1946) Protein requirements of adults. J. Lab. Clin. Med. 31:261-284.
83. Sebrell, W. H. eds. Progress in Meeting Protein Needs of Infants and Preschool Children 1961:541 National Research Council Washington, DC. Publ. No. 843.
84. Autret, M. (1962) Preface. Fridthjof, J. eds. Encouraging the Use of Protein-Rich Foods 1962 FAO Rome, Italy.
85. Carpenter, K. J. (1994) Protein and Energy: a Study of Changing Ideas in Nutrition 1994 Cambridge University Press NewYork, NY.
86. Williams, C. D. (1935) A nutritional disease of children associated with a maize diet. Lancet ii:1151-1152.
87. Trowell, H. C., Davies, J.N.P. & Dean, R.F.A. (1982) Nutrition Foundation Reprint of"Kwashiorkor"1982 Academic Press New York, NY.
88. Brock, J. F. & Autret, M. (1952) Kwashiorkor in Africa 1952 World Health Organization Geneva, Switzerland.
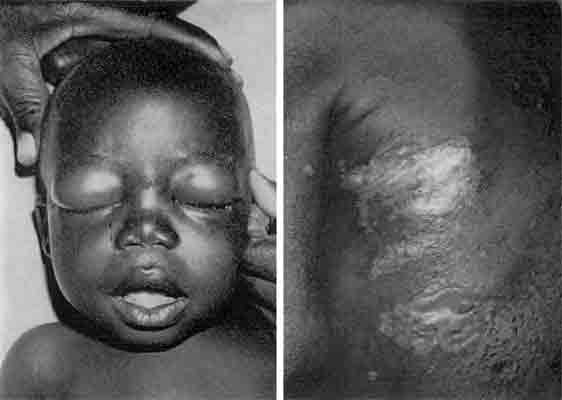
89. Arroyave, G., Wilson, D., Béhar, M. & Viteri, F. (1961) The development of INCAP vegetable mixtures II. Progress in Meeting Protein Needs of Infants and Preschool Children 1961:49-55 National Research Council Publ. No. 843.90. Béhar, M., Viteri, F., Bressani, R., Arroyave, G, Squibb, R. L. & Scrimshaw, N. S. (1958) Principles of treatment and prevention of severe protein malnutrition in children (kwashiorkor). Ann. N. Y. Acad. Sci. 69:954-967.
91. Bras, G., Berry, D. M. & György, P. (1957) Plants as aetiological factor in veno-occlusive disease of the liver. Lancet i:960-962.
92. Naismith, D. J. (1973) Kwashiorkor in Western Nigeria: a study of traditional weaning foods, with particular reference to energy and linoleic acid. Br. J. Nutr. 30:567-576.
93. Advisory Committee on the Application of Science and Technology to Development (1968) International Action to Avert the Impending Protein Crisis 1968 United Nations New York, NY.
94. Tannenbaum, S. R. & Wang, D.I.C. (1975) Single Cell Protein II 1975 MIT Press Cambridge, MA.
95. Calloway, D. H. (1974) The place of SCP in man’s diet. Davis, P. eds. Single Cell Protein 1974:129-146 Academic Press New York, NY.
96. Henry, C.J.K., Donachie, P. A. & Rivers, J.P.W. (1985) The winged bean: will the wonder crop be another flop?. Ecol. Food Nutr. 16:331-338.
97. Pariser, E. R., Wallerstein, M. B., Corkery, C. J. & Brown, N. L. (1978) Fish Protein Concentrate: Panacea for Protein Malnutrition? 1978:225 MIT Press Cambridge, MA.
98. Whitehead, R. G. (1973) The protein needs of malnourished children. Porter, J.W.G. Rolls, B. A. eds. Proteins in Human Nutrition 1973:103-117 Academic Press London, UK.
99. Waterlow, J. C. (1961) The rate of recovery of malnourished infants in relation to the protein and calorie levels of the diet. J. Trop. Ped. 7:16-22.
100. McClaren, D. S. (1974) The great protein fiasco. Lancet ii 93–96:107-109.
101. Carpenter (1994) See citation no. 85, pp. 180–203.
102. Nicol, B. M. (1971) Protein and calorie concentration. Nutr. Rev. 29:83-88.
103. United Nations (1975) Report of the World Food Conference, Rome, 1974 1975 United Nations New York, NY.
104. Scrimshaw, N. S. Altschul, A. M. eds. Amino Acid Fortification of Protein Foods 1971 MIT Press Cambridge, MA.
105. Hedayat, H., Shahbazi, H., Payan, R., Azar, M., Bavendi, M. & Donoso, G. (1973) The effect of lysine fortification of Iranian bread on the nutritional status of schoolchildren. Acta Paediatr. Scand. 62:297-303.
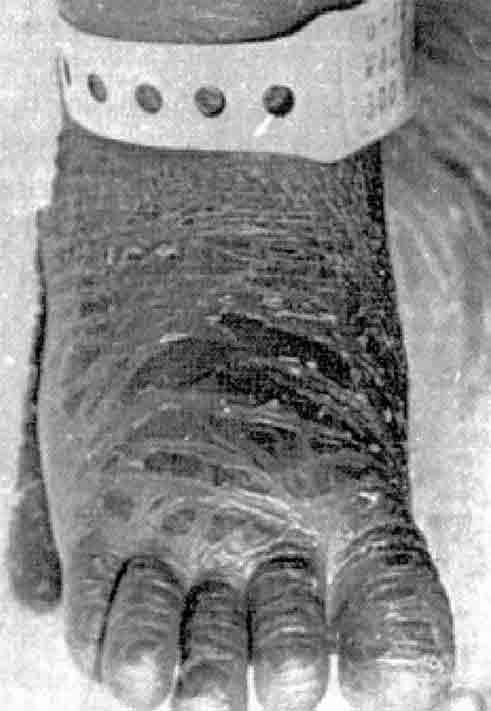
106. Hansen, A. E., Wiese, H. F., Boelsche, A. N., Haggard, M. E., Adam, J. D. & Davis, H. (1963) Role of linoleic acid in infant nutrition. Pediatrics 312:171-192.
107. Paulsrud, J. R., Pensler, L., Whitten, C. F., Stewart, S. & Holman, R. T. (1972) Essential fatty acid deficiency in infants induced by fat-free intravenous feeding. Am. J. Clin. Nutr. 25:897-904.
108. Friedman, Z., Shochat, S. J., Maisels, M. J., Marks, K. H. & Lamberth, E. L. (1976) Correction of essential fatty acid deficiency in newborn infants by cutaneous application of sunflower-seed oil. Pediatrics 58:650-654.
109. Hudson, B.J.F. (1984) Evening primrose (oenothera spp.) oil and seed. J. Am. Oil Chem. Soc. 61:540-543.
110. Steinberg, G., Slaton, W. H., Jr, Howton, D. R. & Mead, J. F. (1956) Incorporation of linoleate into arachidonic acid. J. Biol. Chem. 220:257-264.
111. Fulco, A. J. & Mead, J. F. (1959) Origin of 5, 8, 11-eicosatrienoic acid in the fat-deficient rat. J. Biol. Chem. 234:1411-1416.
112. Holman, R. T. (1960) The ratio of trienoic: tetraenoic acids in tissue lipids as a measure of essential fatty acid requirement. J. Nutr. 70:405-410.
113. Leat, W.M.F. (1962) Studies on pig diets containing different amounts of linoleic acid. Br. J. Nutr. 16:559-569.
114. Rivers, J.P.W., Sinclair, A. J. & Crawford, M. A. (1975) Inability of the cat to desaturate essential fatty acids. Nature 258:171-173.
115. Hansen, H. S. & Jensen, B. (1985) Essential function of linoleic acid esterified in acylglucosylceramide and acylceramide in maintaining the epidermal water permeability barrier. Biochim. Biophys. Acta. 834:357-363.
116. Burr, G. O., Burr, M. M. & Miller, E. S. (1932) On the fatty acids essential in nutrition. J. Biol. Chem. 97:1-9
117. Quackenbush, F. W., Kummerow, F. A. & Steenbock, H. (1942) The effectiveness of linoleic, arachidonic and linolenic acids in reproduction and lactation. J. Nutr. 24:213-224.
118. Tinoco, J., Williams, M. A., Hincenbergs, I. & Lyman, R. L. (1971) Evidence for the non-essentiality of linolenic acid in the diet of the rat. J. Nutr. 101:937-946.
119. Anderson, R. E. & Sperling, L. (1971) Positional distribution of the fatty acids in the phospholipids of bovine retina rod outer segments. Arch. Biochem. Biophys. 144:673-677.
120. Lee, D. J., Roehm, J. N., Yu, T. C. & Sinnhuber, R. O. (1967) Effect of ω-3 fatty acids on the growth rate of rainbow trout. J. Nutr. 92:93-98.
121. Holman, R. T., Johnson, S. B. & Hatch, T. F. (1982) A case of human linolenic acid deficiency involving neurological abnormalities. Am. J. Clin. Nutr. 35:617-623.
122. Neuringer, M., Connor, W. E., Van Petten, C. & Barstad, L. (1984) Dietary omega-3 fatty acid deficiency and visual loss in infant rhesus monkeys. J. Clin. Invest. 73:272-276.
123. Bergström, S., Danielsson, H. & Samuelsson, B. (1963) The structures of prostaglandin E1, F1α and F1ß. J. Biol. Chem. 238:3555-3564.
124. Bergström, S., Ryhage, R., Samuelsson, B. & Sjövall, J. (1964) The enzymatic formation of prostaglandin E2 from arachidonic acid. Biochim. Biophys. Acta. 90:207-210.
125. Hwang, D. H., Mathias, M. M., Dupont, J. & Meyer, D. L. (1975) Linoleate enrichment of diet and prostaglandin metabolism in rats. J. Nutr. 105:995-1002.
126. Portman, O. W. & Hegsted, D. M. (1957) Nutrition. Ann. Rev. Biochem. 26:307-326.
127. Magee, H. E. (1946) Application of nutrition to public health: some lessons of the war. Br. Med. J. i:475-481.
128. Malmros, H. (1950) The relation of nutrition to health: a statistical study of the effect of the war-time on arteriosclerosis, cardiosclerosis, tuberculosis and diabetes. Act. Med. Scand. Suppl. 246:137-150.
129. Strøm, A. & Jensen, R.A.Q. (1951) Mortality from circulatory diseases in Norway 1940–1945. Lancet i :126-129.
130. Rosenthal, S. R. (1934) Studies in atherosclerosis: chemical, experimental and morphologic. Arch. Path. 18:473-506.
131. Gertler, M. M., Garn, S. M. & White, P. D. (1950) Diet, serum and coronary artery disease. Circulation 2:696-704.
132. Keys, A., Mickelsen, O., Miller, E.V.O. & Chapman, C. B. (1950) The relation in man between cholesterol levels in the diet and in the blood. Science 112:79-81.
133. Connor, W. E., Stone, D. B. & Hodges, R. E. (1964) The interrelated effects of dietary cholesterol and fat upon human serum lipid levels. J. Clin. Invest. 43:1691-1696.
134. Keys, A. (1980) Seven Countries: A Multivariate Analysis of Death and Coronary Heart Disease 1980 Harvard University Press Cambridge, MA.
135. Keys, A. (1953) Prediction and possible prevention of coronary disease. Am. J. Publ. Hlth. 43:1399-1407.
136. Keys, A., Anderson, J. T., Aresu, M., Biörck, G., Brock, J. F., Bronte-Stewart, B., Malmros, H., Poppi, A., Posteli, T., Swahn, B. & del Vecchio, A. (1956) Physical activity and the diet in populations differing in serum cholesterol. J. Clin. Invest. 59:1173-1181.
137. Ahrens, E. H., Blankenhorn, D. H. & Tsaltas, T. T. (1954) Effect on human serum lipids of substituting plant for animal fat in diet. Proc. Soc. Exp. Biol. Med. 86:872-878.
138. Ahrens, E. H., Hirsch, J., Insull, W., Jr, Tsaltas, T. T., Blomstrand, R. & Peterson, M. L. (1957) The influence of dietary fats on serum-lipid levels in man. Lancet i:950-953.
139. Jolliffe, N. & Archer, M. (1959) Statistical associations between international coronary heart disease death rates and certain environmental factors. J. Chron. Dis. 9:636-652.
140. Stamler, J. (1979) Population studies. Levy, R. I. Rifkind, B. M. Dennis, B. H. Ernst, N. eds. Nutrition, Lipids and Coronary Heart Disease 1979:25-88 Raven Press New York, NY.
141. Robertson, T. L., Katyo, H., Rhoads, G. G., Kazgan, A., Mmartmot, M., Syme, S. L., Gordon, T., Worth, R. M., Belsky, J. L., Dock, D. S., Miyanishi, M. & Kawamoto, S. (1977) Epidemiological studies of coronary heart disease and stroke in Japanese men living in Japan, Hawaii and California: incidence of myocardial infarction and death from coronary heart disease. Am. J. Cardiol. 39:239-243.
142. Kromhout, D., Keys, A., Aravnis, C., Buzina, R., Fidanza, F., Giampaoli, S., Jansen, A., Menotti, A., Nedeljkovic, S., Pekkarinen, M., Simic, B. S. & Toshima, H. (1989) Food consumption patterns in the 1960s in seven countries. Am. J. Clin. Nutr. 49:889-894.
143. Ferro-Luzzi, A. & Sette, S. (1989) The Mediterranean diet: an attempt to define its present and past composition. Eur. J. Clin. Nutr. 43(Suppl. 2):13-29.
144. James, W.P.T., Duthie, G. G. & Wahle, K.W.J. (1989) The Mediterranean diet: protective or simply non-toxic?. Eur. J. Clin. Nutr. 43(Suppl. 2):31-40.
145. Gofman, J. W., Lindgren, F., Elliott, H., Mantz, W., Hewitt, J., Strisower, B., Herring, V. & Lyon, T. P. (1950) The role of lipids and lipoproteins in atherosclerosis. Science 111:166-171: 186.
146. Olson, R. (1959) Prevention and control of chronic disease 1. Cardiovascular disease. Am. J. Publ. Hlth. 49:1120-1128.
147. Gordon, T., Castelli, W. P., Hjortland, M. C., Kannel, W. B. & Dawber, T. R. (1977) High density lipoprotein as a protective factor against coronary heart disease. Am. J. Med. 62:707-713.
148. National Research Council (1982) Diet, Nutrition and Cancer 1982:5-20 National Academy Press Washington, D.C.
149. Moncado, S. & Vane, J. R. (1981) Prostacyclin: its biosynthesis, actions and clinical potential. Phil. Trans. Roy. Soc. London B. 294:305-329.
150. Iacono, J. M. & Dougherty, R. M. (1983) The role of dietary polyunsaturated fatty acids and prostaglandins in reducing blood pressure and improving thrombogenic indices. Prev. Med. 12:60-69.
151. Bronte-Stewart, B., Antonis, A., Eales, L. & Brock, J. F. (1956) Effects of feeding different fats on serum-cholesterol level. Lancet i:520-527.
152. Ahrens, E. H., Insull, W., Hirsch, J., Farquhar, J. W., Miller, T. & Thomasson, H. J. (1959) The effect on human serum-lipids of a dietary fat, highly unsaturated, but poor in essential fatty acids. Lancet i:115-119.
153. Pfeifer, J. J., Lundberg, W. O., Ishio, S. & Marmanen, E. (1965) Studies of the distribution of lipids in hypercholesteremic rats. 3. Arch. Biochem. Biophys. 110:270-283.
154. Dyerberg, J., Bang, H. O., Stoffersen, E., Moncada, S. & Vane, J. R. (1978) Eicosopentaenoic acid and prevention of thrombosis and atherosclerosis. Lancet ii:117-119.
155. Goodnight, S. H., Jr, Harris, W. S. & Connor, W. E. (1981) The effects of dietary ω-3 fatty acids on platelet composition and function in man: a prospective, controlled study. Blood 58:880-885.
156. Kromhout, D., Bosschieter, E. B. & de Lezenne Coulander, C. (1985) The inverse relation between fish consumption and 20-year mortality from coronary heart disease. New
Engl. J. Med. 312:1205-1209.157. Burkitt, D. P. (1969) Epidemiology of cancer of the colon and rectum. Cancer 28:1-13.
158. Trowell, H. (1972) Ischemic heart disease and dietary fiber. Am. J. Clin. Nutr. 25:926-932.
159. Keys, A., Anderson, J. T. & Grande, F. (1960) Diet-type (fats constant) and blood lipids in man. J. Nutr. 70:257-266.
160. Kay, R. M. & Truswell, A. S. (1977) Effect of citrus pectin on blood lipids and fecal steroid excretion in men. Am. J. Clin. Nutr. 30:171-175.
161. Cummings, J. H., Hill, M. J., Jenkins, D.J.A., Pearson, J. R. & Wiggins, H. S. (1976) Changes in fecal composition and colonic function due to cereal fiber. Am. J. Clin. Nutr. 29:1468-1473.
162. Walker, A.R.P. (1974) Survival rate at middle-age in developing and western populations. Postgrad. Med. J. 50:29-32.
163. Trowell, H. C. Burkitt, D. P. eds. Western Diseases: Their Emergence and Prevention 1981 Harvard University Press Cambridge, MA.
164. Phillips, R. L., Lemon, F. R., Beeson, W. L. & Kuzma, J. W. (1978) Coronary heart disease mortality among Seventh-Day Adventists with differing dietary habits. Am. J. Clin. Nutr. 31:S191-S198.
165. Schweizer, T. F. & Edwards, C. A. (1991) Dietary Fibre—A Component of Food 1991 Springer-Verlag London, UK.
166. Walker, A.R.P. (1978) The relationship between bowel cancer and fiber content in the diet. Am. J. Clin. Nutr. 31:S248-S251.
167. Rose, W. C., Wixom, R. L., Lockhart, H. B. & Lambert, G. F. (1955) The amino acid requirements of man XV. The valine requirement; summary and final observations. J. Biol. Chem. 217:987-995.
|